來源:咸達(dá)數(shù)據(jù) 2015-01-05��,
轉(zhuǎn)自生物谷 http://news.bioon.com/article/6664358.html
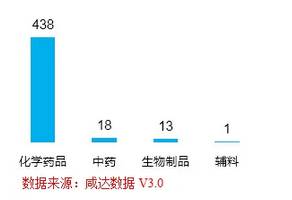
國(guó)家食品藥品監(jiān)督管理總局更新最新的生產(chǎn)批文所對(duì)應(yīng)的獲批時(shí)間是2014年12月25日����。2014年新批生產(chǎn)批文共478件(按受理號(hào)記��,刪除再注冊(cè)相關(guān)批文���,其中國(guó)產(chǎn)418�����,進(jìn)口60)�。化學(xué)藥品以438件占整體批文數(shù)93%的份額�,中藥以18件排名第二,生物制藥13件生產(chǎn)批文排第三(見圖1)�。化學(xué)藥品中����,國(guó)內(nèi)廠家的批文數(shù)為383件,進(jìn)口55件�。
圖1 2014年新批生產(chǎn)批文數(shù)
以藥品通用名計(jì)算(不包含輔料、原料藥����、中間體劑型)�,氨溴索的獲批數(shù)最多�����,共10件生產(chǎn)批文���,其次是蘭索拉唑的7件�,第三是泮托拉唑的6件��。氨溴索和蘭索拉唑都在藥監(jiān)局公布的過度重復(fù)申報(bào)注冊(cè)的藥品品種目錄之中����。
替尼類產(chǎn)品有三個(gè)通用名產(chǎn)品獲批,分別是甲磺酸阿帕替尼和伊馬替尼�。甲磺酸阿帕替尼片恒瑞以1.1類新藥申報(bào),原料藥甲磺酸阿帕替尼批文由江蘇盛迪醫(yī)藥公司獲得���。石藥集團(tuán)歐意藥業(yè)有限公司的甲磺酸伊馬替尼片是國(guó)內(nèi)第二家上市的�����。格列衛(wèi)江蘇豪森在2013年國(guó)內(nèi)第一家仿制上市��。糖尿病新獲批藥品和DDP-4相關(guān)的是諾華的二甲雙胍維格列汀片(Ⅱ)和二甲雙胍維格列汀片(Ⅲ)���,于2014年12月新上市。消化系統(tǒng)用藥中����,江蘇奧賽康藥業(yè)股份有限公司的注射用雷貝拉唑鈉搶在本年12月獲批,南京長(zhǎng)澳制藥有限公司享受了半年多的獨(dú)家劑型期結(jié)束����。
今年無(wú)中藥注射劑獲批。
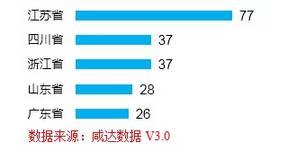
從國(guó)內(nèi)省份來看���,江蘇省77件生產(chǎn)批文排名第一��,占內(nèi)企新批生產(chǎn)批文數(shù)的19%��,其次是四川和浙江�����。
圖2 2014年Top5新批生產(chǎn)批文數(shù)-國(guó)內(nèi)省份
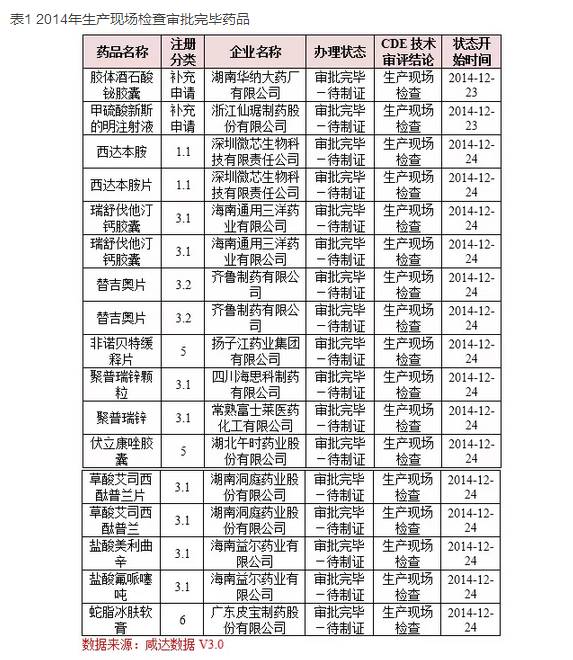
如表1所示��,2014年有17個(gè)產(chǎn)品在12月24日左右生產(chǎn)現(xiàn)場(chǎng)檢查完畢�,“審批完畢-待制證”狀態(tài)中���,其中深圳微芯生物科技有限責(zé)任公司的1.1新藥西達(dá)本胺及西達(dá)本胺片最受關(guān)注����。此產(chǎn)品據(jù)說是我國(guó)首個(gè)獲美國(guó)FDA核準(zhǔn)在美國(guó)進(jìn)行臨床研究的中國(guó)化學(xué)原創(chuàng)新藥,已完成美國(guó)I期臨床試驗(yàn)研究��。
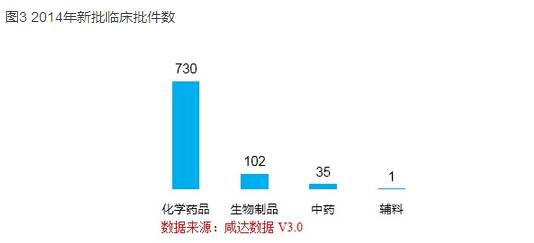
根據(jù)咸達(dá)數(shù)據(jù)V3.0的最新統(tǒng)計(jì)(截止2014年12月31日)����,國(guó)家局更新最新的臨床批文獲批所對(duì)應(yīng)的獲批時(shí)間也是2014年12月25日,以狀態(tài)開始時(shí)間是“2014年”統(tǒng)計(jì)���,共868件臨床批件獲批�����。化學(xué)藥品以730件臨床批件排首位��。生物制品共102件臨床批件�,其中治療用生物制品70件臨床批件�,預(yù)防用生物制品32件。
化學(xué)藥品臨床批件數(shù)中���,屬于1.1類有68件�,3.1類的有242件,6類的有55件�����。1.1類新藥2014年臨床批件數(shù)獲得最多的企業(yè)是江蘇恒瑞����,有8件�,主要是呋格列泛、呋格列泛片�、環(huán)咪德吉和環(huán)咪德吉片;其次是浙江海正(海博非明���、海博非明膠囊��、HPPH和注射用HPPH)��,再次是江蘇豪森(HS-10182片和甲磺酸氟馬替尼片)和江蘇亞盛(APG-1387���、注射用APG-1387、R-(-)-醋酸棉酚和R-(-)-醋酸棉酚片)����。3.1類臨床批件獲批數(shù)排名前三的企業(yè)基本都是研發(fā)企業(yè)�,分別是山東創(chuàng)新藥物研發(fā)有限公司(10件)����、南京華威醫(yī)藥科技開發(fā)有限公司(9件)、山東特瑞林醫(yī)藥科技發(fā)展有限公司(8件)和北京福瑞康正醫(yī)藥技術(shù)研究所(8件)�����。申報(bào)6類排前三的分別是浙江華海(7件)���、北京天衡藥物研究院南陽(yáng)天衡制藥廠(4件)和重慶藥友制藥有限責(zé)任公司(3件)���。
單抗類通用名本國(guó)首次獲批臨床的有Janssen Biotech的人源抗白介素6單克隆抗體(CNTO136)注射液和注射用人源抗IL-17A單克隆抗體(CNTO6785),上海??怪嗅t(yī)藥科技發(fā)展有限公司的碘[131I]愛克妥昔單抗注射液,百濟(jì)神州(北京)生物科技有限公司的注射用Intetumumab單抗(英妥木單抗)�。羅氏未上市的帕妥珠單抗注射液(治療抗人表皮生長(zhǎng)因子受體2,即治療HER2)再次獲得批文�,值得注意的是上海中信國(guó)健的注射用重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白此前已獲批2個(gè)規(guī)格,2014年注射用重組抗HER2人源化單克隆抗體又獲批臨床�。神州細(xì)胞工程的重組全人源抗人表皮生長(zhǎng)因子受體單克隆抗體注射液也在2014獲批臨床。重組人-鼠嵌合抗CD20單克隆抗體注射液2014年浙江海正���、上海復(fù)宏漢霖和信達(dá)生物獲批臨床�。沈陽(yáng)三生的人源化抗人TNFα單克隆抗體注射液(CHO細(xì)胞)和珠海市麗珠的注射用重組人源化抗腫瘤壞死因子α單克隆抗體也獲批臨床。
2014年替尼在本國(guó)通用名首次獲批臨床的有Refametinib�����、邁華替尼和馬來酸艾維替尼��,Bosutinib���、Ibrutinib、甲苯磺酸艾力替尼����、阿昔替尼、甲磺酸氟馬替尼和阿法替尼等再次獲得臨床批文�。杭州華東醫(yī)藥集團(tuán)新藥研究院有限公司的邁華替尼、杭州艾森醫(yī)藥研究有限公司的馬來酸艾維替尼和江蘇豪森醫(yī)藥集團(tuán)連云港宏創(chuàng)醫(yī)藥有限公司的甲磺酸氟馬替尼都是申報(bào)1.1類���。邁華替尼走的是重大專項(xiàng)品種通道��,2014年3月25日CDE承辦�,2014年7月25日重大專項(xiàng)品種開始審評(píng)����,9月30日重大專項(xiàng)品種審評(píng)完成��,2014年10月31日獲得臨床批件����。
糖尿病和DDP-4相關(guān)�,在本國(guó)通用名仍未上市獲批臨床的有勃林格殷格翰國(guó)際貿(mào)易(上海)有限公司利格列汀二甲雙胍片(Ⅰ)、(Ⅱ)和(Ⅲ)���,以及山東綠葉制藥有限公司1.1類新藥酒石酸艾格列汀和酒石酸艾格列汀片�����。酒石酸艾格列汀走了特殊審批通道�,2013年7月30日CDE承辦���,2013年8月9日進(jìn)入特殊審批品種通道�����,2013年6月13日特殊審批品種審評(píng)完成�,2014年6月26日獲批臨床��。
此外,天價(jià)丙肝藥Sofosbuvir片由精鼎醫(yī)藥研究開發(fā)(上海)有限公司申請(qǐng)進(jìn)口臨床的�����,2014年12月26日特殊審批品種審評(píng)已完成����,目前狀態(tài)停在綜合_化藥臨床二部(106)。
根據(jù)咸達(dá)數(shù)據(jù)V3.0的最新統(tǒng)計(jì)(截止2014年12月31日)���,CDE最新受理號(hào)對(duì)應(yīng)的承辦日期是2014年12月31日��。以承辦日期作為統(tǒng)計(jì)���,2014年CDE共有8868條受理號(hào)(含復(fù)審90條�,進(jìn)口再注冊(cè)333條)與2013年的7596條受理號(hào)相比(含復(fù)審81條,進(jìn)口再注冊(cè)127條)�,有所上升。承辦日期為2014年���,2014年CDE技術(shù)審評(píng)結(jié)論是“批準(zhǔn)生產(chǎn)”的數(shù)據(jù)有14條�,7條化藥�����,7條中藥;其中12條是補(bǔ)充申請(qǐng)����,2條6類仿制,為安徽先鋒有限公司藥拉米夫定片����。承辦日期為2014年,2014年CDE技術(shù)審評(píng)結(jié)論是“批準(zhǔn)臨床”的數(shù)據(jù)有45條���,其中38條化藥���,4條生物制劑,3條中藥�����;屬于新藥申請(qǐng)的有12條�,進(jìn)口8條,仿制4條���,補(bǔ)充申請(qǐng)21條�����;屬于新藥申請(qǐng)類別中�����,1條中藥����,3條生物制劑,其余都是化藥�����,其中3.1類兩條����,為浙江海正的對(duì)氨基水楊酸和對(duì)氨基水楊酸腸溶顆粒,1.1類6條����,分別是上文所提及的杭州華東醫(yī)藥集團(tuán)新藥研究院有限公司的邁華替尼和廣東東陽(yáng)光藥業(yè)有限公司的磷酸依米他韋���。廣東東陽(yáng)光藥業(yè)有限公司的磷酸依米他韋既走了特殊審批通道又走了重大專項(xiàng)品種通道���。
坊間傳說明年審評(píng)費(fèi)用即將上升���,目前已經(jīng)宣布小微企業(yè)免征新藥審批費(fèi)和新藥開發(fā)評(píng)審費(fèi),此舉暫且不知道會(huì)不會(huì)刺激研發(fā)未來類同歐美目前趨勢(shì)藥品創(chuàng)新大都在小企業(yè)出成果大企業(yè)負(fù)責(zé)出錢收果子了���,但已經(jīng)有陰謀論說大型和中型醫(yī)藥公司的審批費(fèi)目測(cè)不降反升了�����。面對(duì)未知的升價(jià)�,年底出現(xiàn)申請(qǐng)人連夜排隊(duì)取號(hào)的現(xiàn)象應(yīng)該算正常吧��。隔壁部門CFDA行政事項(xiàng)受理服務(wù)和投訴舉報(bào)中心對(duì)過于熱情的注冊(cè)群眾排隊(duì)表示自家受理工作量過大hold不住�����,發(fā)文公告2014年12月30日至2014年12月31日采用簽收方式接收全部注冊(cè)申報(bào)資料����。CDE仍堅(jiān)守第一線,1月1日又默默更新了受理號(hào)�����,目測(cè)注冊(cè)申報(bào)資料現(xiàn)在還沒有完全錄入庫(kù),根據(jù)咸達(dá)數(shù)據(jù)V3.0的最新統(tǒng)計(jì)(截止2014年12月31日)�����,12月目前承辦數(shù)據(jù)有727條(含復(fù)審8條��,進(jìn)口再注冊(cè)32條)�,12月30日有3條,12月31日有38條��。對(duì)比2013年的數(shù)據(jù)���,2013年12月30日和12月31日�,CDE共承辦1條數(shù)據(jù)(并無(wú)復(fù)審和進(jìn)口再注冊(cè)數(shù)據(jù))�,占2013年12月823條(含復(fù)審4條,進(jìn)口再注冊(cè)22條)不到1%�����?����?磥斫衲昴甑状蠹乙矇蚱吹?。
按2014年12月8日藥監(jiān)局發(fā)布的《食品藥品監(jiān)管總局辦公廳關(guān)于注射劑等無(wú)菌藥品技術(shù)轉(zhuǎn)讓有關(guān)事項(xiàng)的通知》和2013年的38號(hào)文《國(guó)家食品藥品監(jiān)督管理總局關(guān)于做好實(shí)施新修訂藥品生產(chǎn)質(zhì)量管理規(guī)范過程中藥品技術(shù)轉(zhuǎn)讓有關(guān)事項(xiàng)的通知》,自2015年1月1日起���,已獲總局批復(fù)授權(quán)的省級(jí)藥品監(jiān)管機(jī)構(gòu)停止按《通知》的程序和要求受理注射劑等無(wú)菌藥品的技術(shù)轉(zhuǎn)讓注冊(cè)申請(qǐng)�。注射劑等無(wú)菌藥品的技術(shù)轉(zhuǎn)讓注冊(cè)申請(qǐng)���,應(yīng)當(dāng)按照《藥品技術(shù)轉(zhuǎn)讓注冊(cè)管理規(guī)定》(國(guó)食藥監(jiān)注〔2009〕518號(hào))的程序和要求申報(bào)補(bǔ)充申請(qǐng)���,由國(guó)家食品藥品監(jiān)督管理總局進(jìn)行審評(píng)審批。也就是說各省局注射劑的技術(shù)轉(zhuǎn)移即將在2014年關(guān)門��,目前被授權(quán)可以進(jìn)行技術(shù)轉(zhuǎn)移的省份據(jù)說有北京�、上海、廣東���、江蘇���、浙江、山東和遼寧��,四川即將獲批��。截止2014年12月31日�����,全國(guó)注射劑型補(bǔ)充申請(qǐng)CDE及各省省局(省局的數(shù)據(jù)CDE承辦日期目前更新到12月26日)共承辦4867條(含備案數(shù)據(jù)2291條),其中12月承辦373條(含備案157條)����;其中北京133條(含備案66條;其中12月受理8條��,備案2條)���,上海159條(含備案63條�����;其中12月受理6條��,備案5條)�,廣東459條(含備案301條���;其中12月受理30條���,備案27條)、江蘇356條(含備案81條;其中12月受理30條���,備案4條),浙江206條(含備案132條�;其中12月受理6條,備案3條)���,山東363條(含備案63條����;其中12月受理35條�,備案11條)和遼寧150條(含備案78條,12月5條�,備案4條)。根據(jù)本人這兩天查數(shù)據(jù)所獲得的增長(zhǎng)趨勢(shì)來看���,deadline當(dāng)之無(wú)愧是最大生產(chǎn)力���,目測(cè)數(shù)據(jù)還有的漲。
后記:2014年已經(jīng)過去�����,隨著各法規(guī)的執(zhí)行時(shí)間表,預(yù)計(jì)2015年本行業(yè)的藥品批文整體數(shù)量會(huì)有所下降����,行業(yè)洗牌加劇。但2015年會(huì)否真的成為醫(yī)藥行業(yè)研發(fā)的轉(zhuǎn)折點(diǎn)�����,批文數(shù)僅僅是其中一項(xiàng)數(shù)據(jù)表現(xiàn)而已���,藥品批文自身臨床價(jià)值可能更具意義����,畢竟新藥的研發(fā)的起點(diǎn)和終點(diǎn)都應(yīng)該是治療疾病��。本次數(shù)據(jù)整理非常感謝咸達(dá)工作人員的數(shù)據(jù)支持�。2015年期望藥監(jiān)局的數(shù)據(jù)能越來越規(guī)范,CDE的效率越來越高��。