醫(yī)藥網(wǎng)8月28日訊 《中華人民共和國藥品管理法》于35年前(1984.9.20)首次制定����、18年前(2001.2.28)首次修訂�、后經(jīng)6年前(2013.12.28)和4年前(2015.4.24)的兩次修正��,終于2019年8月26日經(jīng)十三屆全國人大常委會第十二次會議表決通過�����,新版《藥品管理法》共12章����、155條、20666字�����。
其中“第二章 藥品研制和注冊”用了14條(即“第十六∽二十九條”���,占全文155條的9%)����、1940字(占全文的9.4%)的篇幅專門對總則“第五條 國家鼓勵研究和創(chuàng)制新藥”進行了詳細論述��,可見新版《藥品管理法》對鼓勵創(chuàng)新的力度之大�。
實際上早在2015年出臺的國辦44號文就開啟了我國鼓勵創(chuàng)新的大幕��、尤其2017年出臺的兩辦文件(42號文)使藥物創(chuàng)新達到了高潮,本法也是將2015年以來發(fā)布的相關(guān)系列文件及成熟的成果上升到法律的高度�,即鼓勵本土創(chuàng)新,又要把國外的創(chuàng)新成果快速引進為患者所用��。
現(xiàn)將《藥品管理法》鼓勵創(chuàng)新的具體條款分述如下:
一�、以臨床價值為導(dǎo)向
第十六條 國家支持以臨床價值為導(dǎo)向、對人的疾病具有明確或者特殊療效的藥物創(chuàng)新����,鼓勵具有新的治療機理、治療嚴重危及生命的疾病或者罕見病����、對人體具有多靶向系統(tǒng)性調(diào)節(jié)干預(yù)功能等的新藥研制,推動藥品技術(shù)進步�����。
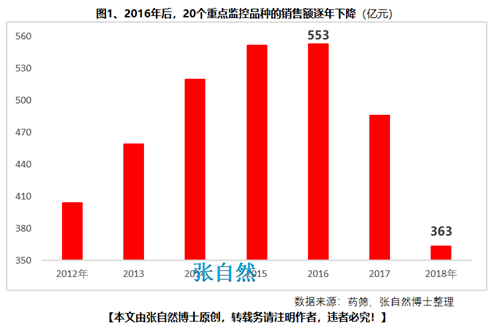
如2019版國家醫(yī)保目錄將衛(wèi)健委發(fā)布的20個重點監(jiān)控品種(圖1)悉數(shù)踢出����,將“非治療性藥物”占用的醫(yī)保基金讓位于具有臨床價值的藥品�����,大幅提高醫(yī)保基金的使用效率�����,真正實現(xiàn)騰籠換鳥�����,造?����;颊?����。
二�、創(chuàng)新審評機制
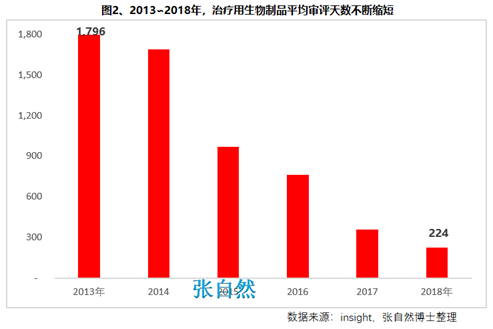
第二十七條 國務(wù)院藥品監(jiān)督管理部門應(yīng)當(dāng)完善藥品審評審批工作制度,加強能力建設(shè)��,建立健全溝通交流�、專家咨詢等機制,優(yōu)化審評審批流程���,提高審評審批效率(圖2)���。
此舉為藥物創(chuàng)新提供了堅強的組織保障。
三����、臨床試驗由批準制改為默示許可制,臨床試驗機構(gòu)由認證管理改為備案管理
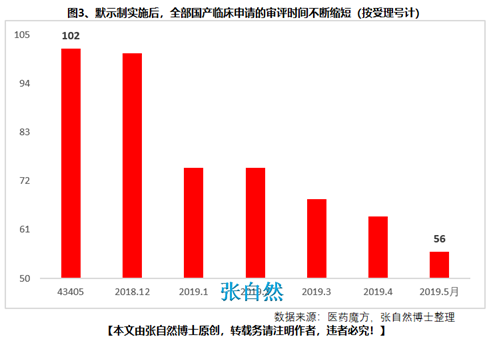
第十九條 開展藥物臨床試驗��,┄┄國務(wù)院藥品監(jiān)督管理部門應(yīng)當(dāng)自受理臨床試驗申請之日起六十個工作日內(nèi)決定是否同意并通知臨床試驗申辦者����,逾期未通知的,視為同意����。┄┄藥物臨床試驗機構(gòu)實行備案管理。
此舉可大幅提高臨床試驗的審批效率(圖3)��。
四�����、建立關(guān)聯(lián)審評審批
第二十五條 ┄┄國務(wù)院藥品監(jiān)督管理部門在審批藥品時�,對化學(xué)原料藥一并審評審批,對相關(guān)輔料��、直接接觸藥品的包裝材料和容器一并審評,對藥品的質(zhì)量標(biāo)準���、生產(chǎn)工藝�、標(biāo)簽和說明書一并核準����。
改革前,特別注重對藥包材本身質(zhì)量的評價�����,單獨審評審批���,關(guān)聯(lián)度差����,導(dǎo)致每個部分(原料�、輔料、包材)過硬���,但是組合后可能不匹配�����。而改為關(guān)聯(lián)審評可真正做到以制劑質(zhì)量為中心����,減少審批項目突出制劑持有人供應(yīng)商和物料管理的責(zé)任,如果發(fā)生問題���,會追責(zé)到個人。
五����、實行優(yōu)先審評審批
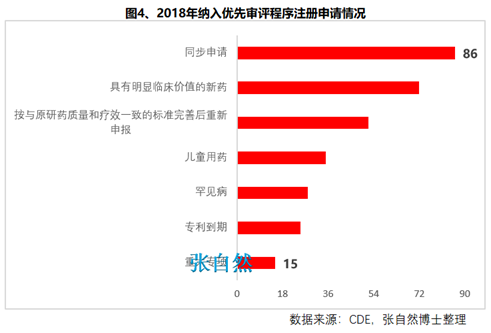
第九十六條 國家鼓勵短缺藥品的研制和生產(chǎn),對臨床急需的短缺藥品����、防治重大傳染病和罕見病等疾病的新藥予以優(yōu)先審評審批。
對上述急需藥品開辟綠色審批審評通道����,大幅提高了藥物可及性(圖4)。
六�、建立了附條件審批制度
第二十六條 對治療嚴重危及生命且尚無有效治療手段的疾病以及公共衛(wèi)生方面急需的藥品,藥物臨床試驗已有數(shù)據(jù)顯示療效并能預(yù)測其臨床價值的����,可以附條件批準���,并在藥品注冊證書中載明相關(guān)事項。
此舉可縮短臨床試驗的研制時間����,使那些急需治療的患者能第一時間用上新藥。
七�、建立藥品上市許可持有人制度
此外,為從制度設(shè)計上鼓勵創(chuàng)新��,本法還專門引入了藥品上市許可持有人制度并成為本次修法的主線����,還為此單列一章“第三章 藥品上市許可持有人”,用了11條(即“第三十∽四十條”�����,占全文155條的7.1%)���、1271字(占全文的6.2%)的篇幅專門對總則“第六條 國家對藥品管理實行藥品上市許可持有人制度”進行了詳細論述���。從此,除生產(chǎn)企業(yè)外,有能力創(chuàng)新出新藥品的科研機構(gòu)�����,也將獲得產(chǎn)品上市后的巨大收益��。
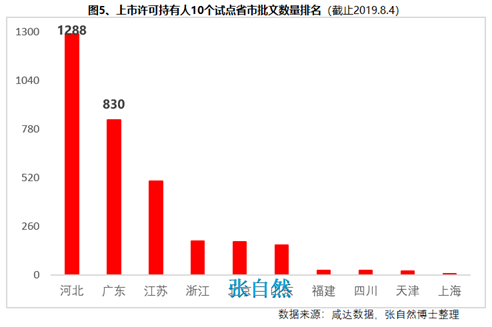
此前��,國務(wù)院已批準了北京等10個省市開展MAH試點����,并已取得了積極成效(圖5)���,對加強藥品全生命周期的管理����,鼓勵創(chuàng)新����、減少低水平重復(fù)、優(yōu)化資源配置發(fā)揮了積極作用��。
總之��,為鼓勵創(chuàng)新,《藥品管理法》總共用了兩章(即“第二和第三章”���,占全文12章的16.7%)��、25條(占全文155條的16.1%)�����、3211字(占全文20666字的15.5%)的超大篇幅進行描述���,我國的藥物創(chuàng)新從此有了法律上的最強保障。
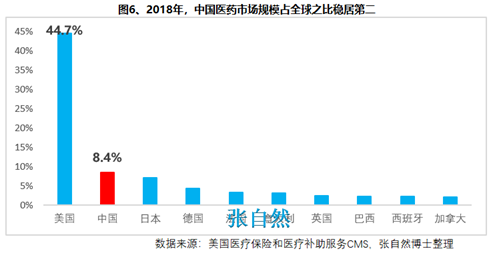
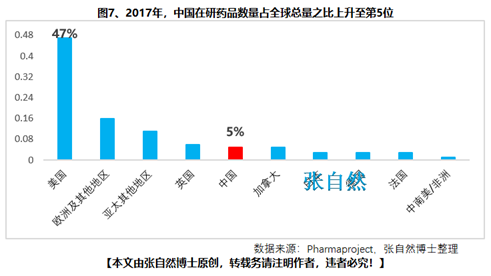
另外����,2018年10月,通過談判將17種抗癌藥納入國家醫(yī)保����,上周,國家醫(yī)保局再擬將128個新藥通過談判納入醫(yī)保�����,以及科創(chuàng)板的創(chuàng)立��,又分別從醫(yī)保支付和資本上給予藥物創(chuàng)新以前所未有的支持,我國的藥物創(chuàng)新可謂已“萬事俱備�、不欠東風(fēng)”,中國的制藥產(chǎn)業(yè)將為中國的患者提供更好的健康保障���,并將以更快的速度實現(xiàn)從制藥大國(圖6)向制藥強國(圖7)的跨越���!