醫(yī)藥網(wǎng)2月25日訊 罕見(jiàn)病雖小�����,卻是一門(mén)大生意?��!段也皇撬幧瘛匪幬镌透窳行l(wèi)��,最初就是以“孤兒藥”獲批��,最后成為年銷(xiāo)售峰值逼近50億美元的超級(jí)“重磅炸彈”�����。在世界罕見(jiàn)病日(2月28日)即將到來(lái)之際���,中美兩國(guó)政府針對(duì)“罕見(jiàn)病”藥物提出不同舉措�����。
中國(guó):加快審批上市+減稅
2月11日�,國(guó)務(wù)院總理李克強(qiáng)主持召開(kāi)國(guó)務(wù)院常務(wù)會(huì)議時(shí)指出�����,要保障2000多萬(wàn)罕見(jiàn)病患者用藥���。為鼓勵(lì)罕見(jiàn)病制藥產(chǎn)業(yè)發(fā)展�����,降低患者用藥成本�,2月20日�,財(cái)政部、海關(guān)總署�、稅務(wù)總局、藥監(jiān)局四個(gè)部門(mén)聯(lián)合發(fā)文����,明確了罕見(jiàn)病藥品增值稅政策��。
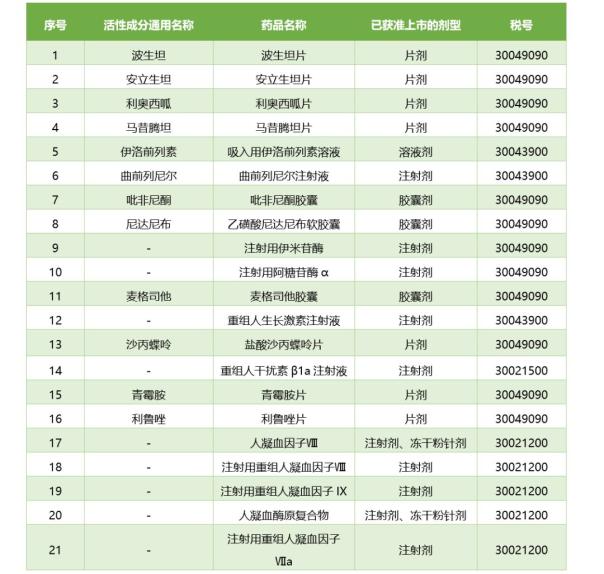
即從3月1日起,對(duì)首批21個(gè)罕見(jiàn)病藥品和4個(gè)原料藥(波生坦���、吡非尼酮�����、青霉胺���、利魯唑),參照抗癌藥對(duì)進(jìn)口環(huán)節(jié)減按3%征收增值稅���,國(guó)內(nèi)環(huán)節(jié)可選擇按3%簡(jiǎn)易辦法計(jì)征增值稅����。在此之前���,這些藥物的增值銳為16%(見(jiàn):官方發(fā)布首批降稅罕見(jiàn)病藥品清單?����。?�。
降稅罕見(jiàn)病藥品清單(第一批)
早在2018年5月21日��,國(guó)家衛(wèi)生健康委員會(huì)等五部門(mén)聯(lián)合制定了《第一批罕見(jiàn)病目錄》�����,首次以官方名義公布了121種罕見(jiàn)性疾病�。在這121個(gè)病種中,而這些病種多數(shù)處于無(wú)藥可治的狀態(tài)���,且只有約20種在國(guó)內(nèi)獲得批準(zhǔn)�。(見(jiàn):官方罕見(jiàn)病目錄背后的中國(guó)孤兒藥開(kāi)發(fā)現(xiàn)狀)����。
更早之前,國(guó)家藥品監(jiān)督管理局(原CFDA)出臺(tái)了鼓勵(lì)創(chuàng)新36條��,明確表示對(duì)于罕見(jiàn)病藥物注冊(cè)審批實(shí)行優(yōu)先審評(píng)�����,特別提出對(duì)境外已批準(zhǔn)上市的罕見(jiàn)病治療藥品醫(yī)療器械�,可附帶條件批準(zhǔn)上市,確認(rèn)試驗(yàn)數(shù)據(jù)可以后續(xù)提供�。在政策的加持下��,罕見(jiàn)病藥物也正以前所未有的速度在中國(guó)推出�。例如�����,羅氏血友病A藥物Hemlibra僅在美國(guó)FDA批準(zhǔn)一年后(2018年11月)獲得批準(zhǔn)�����。
FDA:加強(qiáng)安全評(píng)估+擴(kuò)大同情用藥范圍
無(wú)獨(dú)有偶���,FDA近日也更新了《罕見(jiàn)病用藥開(kāi)發(fā)指南》(Rare Diseases:Common Issues in Drug DevelopmentGuidance for Industry),這是繼2015年后首次在安全性評(píng)估���、自然病史研究和患者參與等方面有重大改進(jìn)�。
在提到安全性的部分時(shí)�����,指南指出�,“可行和充分的安全評(píng)估是屬科學(xué)監(jiān)管范疇, 既基于每種藥物和不同的疾病類(lèi)型帶來(lái)的特殊挑戰(zhàn)�, 也包括患者對(duì)風(fēng)險(xiǎn)的容忍度和未滿足的醫(yī)療需求的程度。”
FDA列舉了數(shù)種加強(qiáng)安全評(píng)估的方法。比如:考慮特定疾病患者的特殊挑戰(zhàn)��,最大限度地?cái)U(kuò)大上市前安全數(shù)據(jù)的收集���。收集可靠的自然病史數(shù)據(jù)����,以便區(qū)分與藥品相關(guān)的不良反應(yīng)和潛在疾病的關(guān)系��。指南特別強(qiáng)調(diào)�����,藥品開(kāi)發(fā)商要嚴(yán)格收集和分析數(shù)據(jù)��。
指南還指出��,臨床試驗(yàn)的患者招募和排除標(biāo)準(zhǔn)應(yīng)該不必要過(guò)多限制患者獲得臨床好處的資格���。 只要倫理和實(shí)踐上可行�, 藥企應(yīng)使用同時(shí)比較的手臂設(shè)計(jì) (例如�, 安慰劑, 不治療�, 護(hù)理標(biāo)準(zhǔn)�, 活性藥物��, 多劑量)�,以便對(duì)不良事件的因果關(guān)系做更好的解釋。
比如設(shè)計(jì)一個(gè)與有效性試驗(yàn)平行運(yùn)行的安全隊(duì)列的試驗(yàn)設(shè)計(jì)協(xié)議����,安全隊(duì)列包括的患者人群是那些研究人員認(rèn)為可能受益于正在臨床試驗(yàn)的新藥物����, 但患者本人又不符合臨床試驗(yàn)入組標(biāo)準(zhǔn)的人。另一個(gè)安全隊(duì)列的患者人群�����,可以是那些接受同情用藥的患者��,即患有重大或危及生命的疾病的患者獲得未經(jīng)FDA批準(zhǔn)的研究性新藥�。
"開(kāi)發(fā)治療罕見(jiàn)疾病的新藥面臨諸多挑戰(zhàn)。比如患者人數(shù)少導(dǎo)致臨床試驗(yàn)招募進(jìn)展緩慢�����;患者本身也很難發(fā)現(xiàn)更多藥企���,找到多種不同藥品����。尤其是對(duì)患友罕見(jiàn)疾病的重癥患者,存在遠(yuǎn)未被滿足的治療需求����。" FDA局長(zhǎng)Scott Gottlieb博士在一份聲明中說(shuō)。“ 擴(kuò)大同情用藥���,不僅有利于藥品開(kāi)發(fā)企業(yè)的臨床數(shù)據(jù)收集�,也利于那些生命垂危又無(wú)法通過(guò)傳統(tǒng)途徑獲得在研新藥的患����。”